리튬이란?
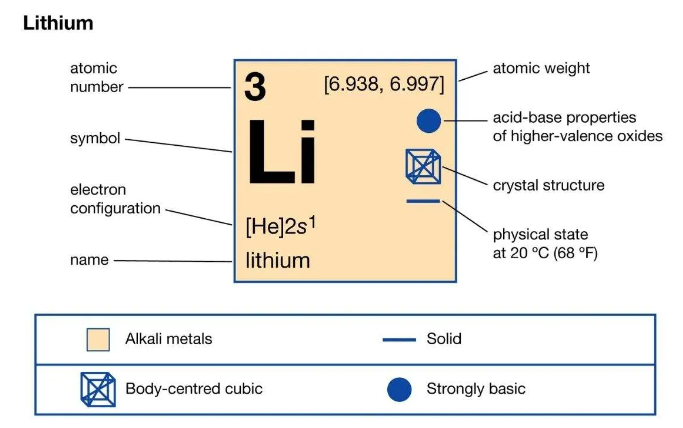
리튬은 3개의 양성자로 구성된 주기율표의 세 번째 원소이며 "Li"는 기호입니다. 그것은 6.941 원자핵의 질량을 가지고 있습니다. 자연계의 리튬은 두 개의 안정한 동위원소인 리튬-6과 리튬-7로 구성됩니다. 원소의 자연 풍부함의 92% 이상이 리튬-7입니다. 리튬은 알칼리족에 속하는 금속입니다. 가장 순수한 형태는 은백색이며 너무 부드러워서 버터 나이프로자를 수 있습니다.
리튬은 금속의 녹는점이 가장 낮고 끓는점이 높습니다. 리튬은 거의 모든 화성암과 광천에서 발견됩니다. 그러나 그것은 무료로 발견되지 않습니다. 수소, 헬륨과 함께 빅뱅이 만들어낸 3대 원소 중 하나였다. 반면에 순수한 원소는 반응성이 너무 커서 자연에서만 발견되며 다른 원소와 결합하여 화합물을 형성합니다.
순수한 리튬 금속을 사용하는 경우 오일 아래에서 부식성이 매우 강하거나 밀폐된 대기 내부에서 금속이 산화되지 않도록 보호되므로 각별한 주의가 필요합니다. 리튬과 산소의 결합은 화재가 발생했을 때 진화를 더 어렵게 만듭니다.
리튬은 의료, 열 전달제, 합금 생산, 배터리 등에 사용됩니다. 리튬 화합물이 기분을 좋게 하는 것으로 잘 알려져 있지만 과학자들은 여전히 그 효과에 대해 당혹스러워합니다.
리튬의 역사
1790년대에 처음 발견된 광물인 페탈라이트는 불에 타면 붉게 타오르는 것으로 알려져 있습니다. 스웨덴 화학자 요한 아우구스트 아르베드손은 1817년 이 광물에 색깔 있는 불꽃의 원인이 되는 알려지지 않은 성분이 포함되어 있음을 발견했습니다. 그의 최선의 노력에도 불구하고 Arfvedson은 그가 식별한 물질에서 순수한 금속을 생산할 수 없었습니다.
그리스어 olthos'stone에서 파생된 Lithion'은 그의 학자인 Jöns Jakob Berzelius에 의해 이름으로 제공되었습니다. 이 이름은 알려진 다른 두 알칼리 금속인 나트륨과 칼륨의 이름과 마찬가지로 그것이 파생된 물질을 식별합니다. 라틴화된 형태의 리튬이 마침내 승리했습니다.
독일 화학자 Christian Gottlob Gmelin은 1818년에 리튬염이 붉은 불꽃을 생성한다는 것을 발견했습니다. 그 후 몇 년 동안 두 과학자 모두 이 물질을 분리하는 데 실패했습니다. 그것은 원래 1818년에 William Thomas Brande와 Humphry Davy 경에 의해 산화리튬 전해법(Li2O)을 사용하여 완성되었습니다.
1855년 Robert Bunsen과 Augustus Matthiessen이 염화리튬(LiCl)을 전기분해하여 더 많은 양의 순수한 리튬을 만들었습니다. Wilhelm Schlenk는 1917년에 유기 수은 화합물로부터 최초의 유기 리튬 화합물을 만들었습니다. 독일 금속 회사는 1923년에 Harz의 Langelsheim에 있는 Hans-Heinrich-Hütte에서 리튬과 염화칼륨(KCl)의 용융물을 전기분해하여 상업 생산을 시작했습니다.
윤활제(스테아르산리튬으로 농축된 광유)와 유리 산업에서 제2차 세계 대전 이후까지 리튬은 용도가 거의 없었습니다(탄산리튬 또는 산화리튬). 미국이 리튬에서 합성할 수 있는 수소 폭탄을 개발하기 위해 삼중수소가 필요했을 때 상황이 바뀌었습니다. 특히 노스캐롤라이나 주 킹스 마운틴 주변에서 대규모 캠페인을 시작했습니다.
필요한 리튬 삼중수소 반감기가 짧기 때문에 1953년에서 1963년 사이에 상당한 양의 리튬이 수집되어 마침내 1993년 냉전이 종식된 후 시장에 출시되었습니다. 채광 외에도 염수 추출이 점점 더 중요해지고 있습니다.
리튬 제조 공정
리튬은 일반적으로 염수(지하수, 염호)의 증발에서 추출됩니다. 노천 채굴에서 암석을 얻는 것은 매우 드뭅니다. 식염수를 지표로 끌어올리고 태양 아래에서 몇 달 동안 증발시켜 리튬을 모은다. 처리 공장은 용액을 펌핑하여 연못 물에서 여과된 원치 않는 붕소와 마그네슘을 제거합니다. 그런 다음 그녀는 탄산나트륨 요법을 받게 됩니다.
필터와 탈수기를 사용하여 침전된 액상 탄산리튬을 제거합니다. 솔트레이크는 과도한 염수로 다시 채워집니다. 지하수 사용은 칠레와 같은 건조 국가에서 지형의 건조를 가속화합니다.
탄산리튬은 물을 증발시키고 탄산나트륨(소다)을 첨가함으로써 리튬 함유 염 용액으로부터 침전된다. 염수는 리튬 농도의 5% 이상이 될 때까지 공기 중에 먼저 농축됩니다. 약하게만 용해되는 탄산리튬은 탄산나트륨에 첨가될 때 침전된다.
2LiCl + Na2CO3 = Li2CO3 + 2NaCl
탄산리튬은 먼저 염산으로 처리하여 금속 리튬을 생성합니다. 이산화탄소가 기체로 방출되고 염화리튬이 용해됩니다. 진공 증발기는 염화물이 결정화될 때까지 용액을 농축하는 데 사용됩니다.
Li2CO3 + 2H3O+ + 2Cl– = 2Li+ + 2Cl– + CO2 + 3H2O
염수는 부식성이 매우 높기 때문에 염화리튬 추출 장비에는 특수강 또는 니켈 합금이 필요합니다. 450~500°C 녹는 공융 염화리튬과 염화칼륨의 혼합물을 용융염 전기분해를 이용하여 금속 리튬을 생성할 수 있습니다.
칼륨은 염화물 용융물에서 더 낮은 전극 전위를 가지기 때문에 전기분해에서 침전되지 않습니다. 있습니다. 그러나 미량의 나트륨은 리튬의 반응성을 높입니다(유기 화학에는 이롭고 Li 배터리에는 좋지 않음).
리튬 액체는 전해질 표면에 수집되고 전기분해 전지에서 상대적으로 제거하기 쉽기 때문에 그곳에 농축됩니다. 피리딘에서 염화리튬을 전기분해하여 리튬을 추출할 수도 있습니다. 이 기술은 실험실 환경에서 사용하기에 가장 적합합니다.
리튬 화합물
리튬의 일부 일반적인 화합물은 다음과 같습니다.
▷ 리튬 알루미늄 하이드라이드(LiAlH4)
▷ 붕산리튬(Li2B4O7)
▷ 탄산리튬(Li2CO3)
▷ 염화리튬(LiCl)
▷ 수소화리튬(LiH)
▷ 수산화리튬(LiOH)
▷ 니오브산리튬(LiNbO3)
▷ 탄탈산 리튬(LiTaO)
리튬의 속성
▷ 유기 및 무기 반응물은 다양한 화학 반응에서 리튬과 상호 작용합니다. 일산화탄소와 과산화수소는 산소와 결합하면 형성됩니다.
▷ 물은 Metallic Lithium과 격렬하게 반응하므로 매우 위험합니다.
▷ 이 금속의 발열량은 가장 중요한 특성 중 하나입니다. 다른 특성으로는 넓은 액체 온도 범위와 우수한 열전도율이 있습니다.
▷ 리튬의 밀도와 점도는 모두 매우 낮습니다.
▷ 예를 들어 에틸아민은 이 원소를 금속 상태로 용해시키는 반면 탄화수소는 용해하지 않습니다.
리튬의 용도
▷ LA-141(리튬 14%, 알루미늄 1%, 마그네슘 85%)과 같이 리튬을 함유한 저밀도 알루미늄-마그네슘 합금을 만드는 것이 가능합니다. 이 금속 합금은 항공기 제조에 사용됩니다. 윤활 그리스는 오일에서 윤활 그리스로의 전환 과정에서 희석제 또는 겔화제로 작용하는 리튬 스테아레이트(LiOH + 수지) 덕분에 방수성이 뛰어납니다.
▷ 이산화탄소는 수산화리튬을 사용하여 우주선과 잠수함에 흡수됩니다. 수소는 군사 또는 도량형 목적으로 원소 수소화물에서 생성될 수 있습니다. 알칸 또는 파라핀과 같은 탄화수소 및 알켄 또는 올레핀은 다양한 유기 리튬 화학 물질을 사용하여 합성할 수 있습니다.
▷ 전기의 흐름을 증가시키거나 생산 비용을 절감하여 알루미늄을 추출하기 위해 세포에서 널리 사용되며, 도자기 및 법랑질을 만드는 플럭스로 활용되며, 조울증 정신병을 치료하기 위한 의약에서 널리 사용됩니다. – 탄산리튬.
▷ 용융 염화리튬 또는 염화칼륨의 양극으로 사용되는 Li-Si 및 Li-Al 합금은 축전지 또는 전지에서 전류를 생성하기 위해 테스트되고 있습니다. 삼중수소(수소의 동위원소)는 핵융합 과정에서 촉진 연료이며 리튬을 사용하여 이를 생산할 수 있습니다.
'슬기로운 기계생활' 카테고리의 다른 글
| 나트륨이란? – 화합물, 속성 및 용도 (0) | 2022.09.28 |
|---|---|
| 베릴륨이란? – 합금, 특성 및 용도 (2) | 2022.09.27 |
| 청동이란? – 속성, 유형 및 용도 (0) | 2022.09.25 |
| 황동이란? – 속성, 유형 및 용도 (2) | 2022.09.24 |
| 아연이란? – 화합물, 합금 및 특성 (2) | 2022.09.23 |